3
Основные положения ТЭД.
1) По способности проводить электрический ток в растворах
| все вещества делятся на | |
|---|---|
| электролиты 1) Щёлочи NaOH, KOH 2) Растворимые кислоты HCl, H2SO4 3) Растворимые соли NaCl, NaNO3 |
неэлектролиты 1) Нерастворимые основания Fe(OH)2, Cu(OH)2 2) Нерастворимая кислота H2SiO3 3) Нерастворимые соли BaSO4, CaCO3 4) Оксиды 5) Многие органические вещества 6) Простые вещества |
2) В растворах электролиты распадаются на ионы, т. е. диссоциируют. Ионы различают:
| по составу | |
| простые (примеры: K+, I-) |
сложные (примеры: NH4+, SO42-) |
| по заряду | |||||
| положительные или катионы (примеры: K+, I-) |
отрицательные или анионы (примеры: NH4+, SO42-) |
||||
| H+ | K+ | NH4+ | OH- | кислотные остатки |
|
| по наличию водной оболочки | |
| гидратированные | негидратированные |
| ЭЛЕКТРОЛИТЫ С ИОННОЙ СВЯЗЬЮ (ЩЁЛОЧИ, СОЛИ) | ЭЛЕКТРОЛИТЫ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ (КИСЛОТЫ) |
|---|---|
Ориентация молекул воды вокруг противоположно заряженных ионов электролита.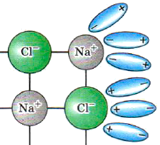 |
Ориентация молекул воды вокруг электроотрицательного и электроположительного концов молекулы электролита.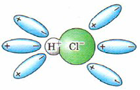 |
| Гидратация – взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя электролита. | Гидратация – взаимодействие молекул воды с молекулами электролита. |
| Ионизация – превращение ковалентной полярной связи в ионную. | |
| Диссоциация – распад на катионы металла или аммония и на гидроксид-анионы или анионы кислотного остатка. | Диссоциация – распад на катионы водорода и анионы кислотного остатка. |
3) Разные электролиты по разному диссоциируют на ионы, что характеризует степень электролитической диссоциации – α.
| По α электролиты делятся на | ||
|---|---|---|
| слабые (α ⟶ 0) диссоциируют обратимо (⇄) 1) MgS ⇄ Mg2+ + S2- 2) CH3COOH ⇄ CH3COO- + H+ 3) NH4OH ⇄ NH4+ + OH- |
сильные (α ⟶ 1) диссоциируют необратимо (⟶) 1) HCl ⟶ H+ + Cl- 2) KOH ⟶ K+ + OH- 3) NaNO3 ⟶ Na+ + NO3- |
|
α зависит:
– от природы электролита, например: нерастворимые основания практически не диссоциируют (α = 0), а растворимые диссоциируют практически полностью (α = 1).
– от разбавления (как?) степень диссоциации растёт по мере разбавления раствора.
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Например:
HNO3 = H+ + NO3-;
H2SO4 = 2H+ + SO42-.
б) Основания – это электролиты, которые диссоциируют на катионы металла и гидроксид-анионы.
Например:
KOH = K+ + OH-;
Ba(OH)2 = Ba2+ + 2OH-.
в) Соли – это электролиты, которые диссоциируют на катионы металла (или аммония) и анионы кислотного остатка.
Например:
Fe(NO3)3 = Fe3+ + 3NO3-;
AlCl3 = Al3+ + 3Cl-.