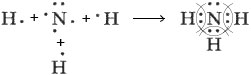1
По плану, рассмотренному на прошлом уроке, дайте характеристику элемента фосфора.
1) Это элемент VA группы, 3-го малого периода.
2) 15P 2ē, 8ē, 5ē.
3) Фосфор может проявлять окислительные свойства по отношению к металлам и водороду, а также восстановительные свойства по отношению к более электроотрицательным элементам, например: O, F, Cl.
4-6) Для фосфора характерно явление аллотропии. Он образует две аллотропные модификации: P красный и P белый. У первого атомная кристаллическая решётка, а у второго – молекулярная кристаллическая решётка и формула P4. Следовательно, причиной аллотропии фосфора является различие в типах кристаллических решеток.
Фосфор красный и молекулы P4 образованы за счёт ковалентной неполярной связи. Между молекулами P4 слабые межмолекулярные силы взаимодействия.
7-8) P > активный НМ, чем Si, но < активный, чем S.
Фосфор < активный восстановитель, чем Si, но > активный, чем S.
9) Высший оксид фосфора имеет формулу P2O5 и название оксид фосфора (V).
Это кислотный оксид.
Он взаимодействует (запишите уравнения возможных реакций, в том числе в полной и сокращённой ионной форме для реакций с участием электролитов):
с основным оксидом P2O5 + CaO = Ca3(PO4)2
с водой P2O5 + 3H2O = 2H3PO4
со щелочью P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 6Na+ + 6OH- = 6Na+ + 2PO43- + 3H2O
P2O5 + 6OH- = 2PO43- + 3H2O
10) Высший гидроксид фосфора – это фосфорная кислота, формула которой H3PO4.
Это трёхосновная, кислородсодержащая, растворимая в воде, нелетучая, стабильная, но слабая кислота. Поэтому в ионных уравнениях реакций с участием фосфорной кислоты её формулу следует записывать в молекулярной форме.
Реакция с металлами для фосфорной кислоты нехарактерна. Остальные свойства – типичные для кислот. Она взаимодействует (составьте уравнения возможных реакции – молекулярные, полные и сокращённые ионные):
с основными оксидами
2H3PO4 + 3Na2O ⟶ 2Na3PO4 + 3H2O
2H3PO4 + 3Na2O ⟶ 6Na+ + 2PO43- + 3H2O
с щелочами
H3PO4 + 3KOH ⟶ K3PO4 + 3H2O
H3PO4 + 3K+ + 3OH- ⟶ 3K+ + PO43- + 3H2O
H3PO4 + 3OH- ⟶ PO43- + 3H2O
с солями, если образуется ↓ или ↑
2H3PO4 + 3Na2CO3 ⟶ 2Na3PO4 + 3H2O + 3CO2↑
2H3PO4 + 6Na+ + 3CO32- ⟶ 6Na+ + 2PO43- + 3H2O + 3CO2↑
2H3PO4 + 3CO32- ⟶ 2PO43- + 3H2O + 3CO2↑
2H3PO4 + 3BaCl2 ⟶ 6HCl + Ba3(PO4)2↓
2H3PO4 + 3Ba2+ + 6Cl- ⟶ 6H+ + 6Cl- + Ba3(PO4)2↓
2H3PO4 + 3Ba2+ ⟶ 6H+ + Ba3(PO4)2↓
11) Летучее водородное соединение фосфора имеет формулу PH3. Оно построено за счёт ковалентной химической связи. Схема её образования: