1
Сероводород.
1) Строение молекулы:
Молекулярная формула – H2S.
Электронная формула – 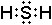
Структурная формула – H–S–H
Тип связи – ковалентная полярная.
2) Физические свойства: бесцветный газ, с характерным запахом тухлых яиц, тяжелее воздуха, частично растворим в воде.
3) Химические свойства (закончите уравнения реакций и рассмотрите уравнения в свете ТЭД пли с позиций окисления-восстановления).
| а) 2H2S + O2(недост.) ⟶ 2S + 2H2O | ||||
| S-2 - 2ē ⟶ S0 | 2 | 4 | 2 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 1 | окислитель (восстановление) | |
| б) 2H2S + 3O2 ⟶ 2SO2 + 2H2O | ||||
| S-2 - 6ē ⟶ S+4 | 6 | 12 | 2 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 3 | окислитель (восстановление) | |
в) H2S + 2NaOH(изб.) ⟶ Na2S + 2H2O
H2S + 2Na+ + 2OH- ⟶ 2Na+ + S2- + 2H2O
H2S + 2OH- ⟶ S2- + 2H2O
в) H2S + NaOH(недост.) ⟶ NaHS + H2O
H2S + Na+ + OH- ⟶ Na+ + HS- + H2O
H2S + OH- ⟶ HS- + H2O
в) H2S + CuCl2 ⟶ 2HCl + CuS↓
H2S + Cu2+ + 2Cl- ⟶ 2H+ + 2Cl- + CuS↓
H2S + Cu2+ ⟶ 2H+ + CuS↓
4) Сероводород в природе: содержится в попутных газах нефтяных месторождений, в природном и вулканическом газах, в минеральных водах, образуется при разложении белковых веществ.