Вариант 1
1. Дайте краткую характеристику элемента серы. Положение в Периодической системе; электронная конфигурация атомов; валентные возможности; возможные степени окисления (с примерами веществ); высший оксид, его характер; высший гидроксид, его характер; водородное соединение.
2. Даны следующие вещества: фтор, фторид натрия, фторид кислорода (II). Напишите формулы этих веществ и определите тип химической связи. Покажите направление смещения электронной плотности, если она смещена; ответ мотивируйте. Составьте электронные формулы для данных веществ.
3. Закончите уравнения реакций, составьте схемы электронного баланса и расставьте коэффициенты в уравнениях.
P + O2 = …
Li + N2 = …
Zn + Fe2(SO4)3 = …
4. Преобразуйте данные схемы в уравнения реакций, составьте схемы электронного баланса.
NH3 + O2 ⟶ N2 + H2O
Cu + HNO3(разб.) ⟶ Cu(NO3)2 + NO↑ + H2O
1.
2.
| Название вещества | Формула вещества | Тип химической связи | Смещение электронной плотности | Электронная формула |
|---|---|---|---|---|
| Фтор | F2 | Ковалентная неполярная | Не смещена, так как молекула вещества образована одним элементом. | 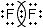 |
| Фторид натрия | NaF | Ионная | Na⟶F Так как фтор более электроотрицательный элемент, чем натрий. |
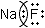 |
| Фторид кислорода (II) | OF2 | Ковалентная полярная | F⟵O⟶F Так как фтор более электроотрицательный элемент, чем кислород. |
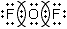 |
3.
| 4P + 5O2 = 2P2O5 | ||||
| P0 - 5ē ⟶ P+5 | 5 | 20 | 4 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 5 | окислитель (восстановление) | |
| 6Li + N2 = 2Li3N | ||||
| Li0 - 1ē ⟶ Li+1 | 1 | 6 | 6 | восстановитель (окисление) |
| N20 + 6ē ⟶ 2N-3 | 6 | 1 | окислитель (восстановление) | |
| 3Zn + Fe2(SO4)3 = 3ZnSO4 + 2Fe | ||||
| Zn0 - 2ē ⟶ Zn+2 | 2 | 6 | 3 | восстановитель (окисление) |
| Fe+3 + 3ē ⟶ Fe0 | 3 | 2 | окислитель (восстановление) | |
4.
| 4NH3 + 3O2 ⟶ 2N2 + 6H2O | ||||
| 2N-3 - 6ē ⟶ N20 | 6 | 12 | 2 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 3 | окислитель (восстановление) | |
| 3Cu + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 2NO↑ + 4H2O | ||||
| Cu0 - 2ē ⟶ Cu+2 | 2 | 6 | 3 | восстановитель (окисление) |
| N+5 + 3ē ⟶ N+2 | 3 | 2 | окислитель (восстановление) | |