Проверьте 1
По приведённому в параграфе плану дайте характеристику химических элементов:
а) калия;
б) магния;
в) серы;
г) хлора.
а) Калий
1. Атомный номер калия 19 (Z = 19). Элемент калий расположен в IA группе, в четвёртом периоде.
2. Заряд ядра +19, оно содержит 19 протонов. Число нейтронов в ядре равно 20. Число электронов на электронной оболочке также равно 19, так как атом электронейтрален. Схема распределения электронов по энергетическим уровням: 2ē; 8ē; 8ē; 1ē.
3. На внешнем энергетическом уровне атома калия два валентных электрона. Калий – это элемент-металл. Простое вещество калий, образованное атомами данного химического элемента, также является металлом, следовательно, для него характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: тепло- и электропроводность, пластичность, металлический блеск.
4. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что объясняется ростом радиуса атома в ряду Na – K – Rb.
5. Металлические свойства у калия выражены сильнее, чем у кальция, что связано с увеличением числа валентных электронов в ряду K – Ca – Ga.
6. Максимальная степень окисления калия равна +1, так как его атом содержит один валентный электрон. Формула высшего оксида магния – K2O. Он является основным оксидом, следовательно, взаимодействует с водой, кислотами и кислотными оксидами:
K2O + H2O ⟶ 2KOH
K2O + H2SO4 ⟶ K2SO4 + H2O
K2O + CO2 ⟶ K2CO3
7. Формула гидроксида калия – KOH. Он является растворимым основанием – щёлочью, следовательно, взаимодействует с кислотами, кислотными оксидами и солями:
2KOH + H2SO4 ⟶ K2SO4 + 2H2O
2K+ + 2OH- + 2H+ + SO42- ⟶ 2K+ + SO42- + 2H2O
H+ + OH- ⟶ H2O
2KOH + SO3 ⟶ K2SO4 + H2O
2K+ + 2OH- + SO3 ⟶ 2K+ + SO42- + H2O
2OH- + SO3 ⟶ SO42- + H2O
2KOH + CuSO4 ⟶ K2SO4 + Cu(OH)2↓
2K+ + 2OH- + Cu2+ + SO22- ⟶ 2K+ + SO42- + Cu(OH)2↓
Cu2+ + 2OH- ⟶ Cu(OH)2↓
8. Калий не имеет летучего водородного соединения, но образует твёрдое бинарное соединение ионного типа – гидрид калия KH.
б) Магний
1. Атомный номер магния 12 (Z = 12). Элемент магний расположен во IIA группе, в третьем периоде.
2. Заряд ядра +12, оно содержит 12 протонов. Число нейтронов в ядре равно 12. Число электронов на электронной оболочке также равно 12, так как атом электронейтрален. Схема распределения электронов по энергетическим уровням: 2ē; 8ē; 2ē.
3. На внешнем энергетическом уровне атома магния два валентных электрона. Магний – это элемент-металл. Простое вещество магний, образованное атомами данного химического элемента, также является металлом, следовательно, для него характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: тепло- и электропроводность, пластичность, металлический блеск.
4. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция, что объясняется ростом радиуса атома в ряду Be – Mg – Ca.
5. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия, что связано с увеличением числа валентных электронов в ряду Na – Mg – Al.
6. Максимальная степень окисления магния равна +2, так как его атом содержит два валентных электрона. Формула высшего оксида магния – MgO. Он является основным оксидом, следовательно, взаимодействует с кислотами, кислотными оксидами:
MgO + H2SO4 ⟶ MgSO4 + H2O
MgO + CO2 ⟶ MgCO3
7. Формула гидроксида магния – Mg(OH)2. Он является растворимым основанием, следовательно, взаимодействует с кислотами и кислотными оксидами:
Mg(OH)2 + H2SO4 ⟶ MgSO4 + 2H2O
Mg(OH)2 + 2H+ + SO42- ⟶ Mg2+ + SO42- + 2H2O
Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O
Mg(OH)2 + SO3 ⟶ MgSO4 + H2O
Mg(OH)2 + SO3 ⟶ Mg2+ + SO42- + H2O
8. Магний не имеет летучего водородного соединения, но образует твёрдое бинарное соединение ионного типа – гидрид магния MgH2.
в) Сера
1. Атомный номер серы 16 (Z = 16). Сера расположена в VIIА группе, в третьем периоде.
2. Заряд атомного ядра +16, оно содержит 16 протонов и 16 нейтронов. В электронной оболочке содержится 16 электронов. Схема распределения электронов по энергетическим уровням: 2ē; 8ē; 6ē.
3. Сера образует несколько простых веществ – неметаллов, следовательно, для неё характерно явление аллотропии.
4. Неметаллические свойства у серы выражены слабее, чем у хлора, но сильнее, чем у фосфора, что объясняется ростом радиуса атома в ряду F – Cl – Br.
5. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее чем у хлора, что связано с увеличением числа валентных электронов в ряду P – S – Cl.
6. Максимальная степень окисления серы равна +6, так как его атом содержит шесть валентных электронов. Формула высшего оксида серы – SO3. Это кислотный оксид, взаимодействует с водой, щелочами и основными оксидами:
SO3 + H2O ⟶ H2SO4
SO3 + Na2O ⟶ Na2SO4
SO3 + 2NaOH ⟶ Na2SO4 + H2O
7. Гидроксид серы (VI) – серная кислота H2SO4 взаимодействует с основаниями, основными оксидами и солями:
H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH- ⟶ 2Na+ + SO42- + 2H2O
H+ + OH- ⟶ H2O
H2SO4 + MgO ⟶ MgSO4 + H2O
2H+ + SO42- + MgO ⟶ Mg2+ + SO42- + H2O
2H+ + MgO ⟶ Mg2+ + H2O
H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH- ⟶ 2Na+ + SO42- + 2H2O
H+ + OH- ⟶ H2O
8. Формула летучего водородного соединения – H2S.
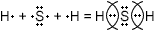
г) Хлор
1. Атомный номер хлор 17 (Z = 17). Хлор расположен в VIIА группе, в третьем периоде.
2. Заряд атомного ядра +17, оно содержит 17 протонов и 18 нейтронов. В электронной оболочке содержится 17 электронов. Схема распределения электронов по энергетическим уровням: 2ē; 8ē; 7ē.
3. У хлора нет аллотропных модификаций.
4. Неметаллические свойства у хлора выражены слабее, чем у фтора, но сильнее, чем у брома, что объясняется ростом радиуса атома в ряду F – Cl – Br.
5. Неметаллические свойства у хлора выражены сильнее, чем у фосфора и серы, что связано с увеличением числа валентных электронов в ряду P – S – Cl.
6. Максимальная степень окисления хлора равна +7, так как его атом содержит семь валентных электронов. Формула высшего оксида хлора – Cl2O7. Это кислотный оксид, взаимодействует с водой, щелочами и основными оксидами:
Cl2O7 + H2O ⟶ 2HClO4
Cl2O7 + Na2O ⟶ 2NaClO4
Cl2O7 + 2NaOH ⟶ 2NaClO4 + H2O
7. Гидроксид хлора (VII) – хлорная кислота HClO4 взаимодействует с основаниями, основными оксидами и солями:
HClO4 + NaOH ⟶ NaClO4 + H2O
H+ + ClO4- + Na+ + OH- ⟶ Na+ + ClO4- + H2O
H+ + OH- ⟶ H2O
2HClO4 + MgO ⟶ Mg(ClO4)2 + H2O
2H+ + 2ClO4- + MgO ⟶ Mg2+ + 2ClO4- + H2O
2H+ + MgO ⟶ Mg2+ + H2O
2HClO4 + Na2CO3 ⟶ 2NaClO4 + H2O + CO2↑
2H+ + 2ClO4- + 2Na+ + CO32- ⟶ 2Na+ + 2ClO4- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑
8. Формула летучего водородного соединения – HCl.