8-46
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ.
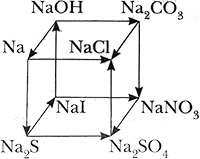
Для реакций, протекающих в растворе с участием ионов, составьте ионные уравнения. К уравнениям всех окислительно-восстановительных реакций составьте схему электронного баланса или покажите переход электронов стрелкой.
2NaOH + CO2 = Na2CO3 + H2O
2Na+ + 2OH- + CO2 = 2Na+ + CO32- + H2O
2OH- + CO2 = CO32- + H2O
| 4NaOH(распл.) `overset("электролиз")(=)` 4Na + 2H2O + O2↑ | ||||
| 4OH- - 4ē ⟶ 2H2O + O2 | 4 | 4 | 1 | |
| Na+ + 1ē ⟶ Na | 1 | 4 | ||
| 2Na + Cl2 = 2NaCl | ||||
| Na0 - 1ē ⟶ Na+ | 1 | 2 | 2 | |
| Cl20 + 2ē ⟶ 2Cl- | 2 | 1 | ||
| 2Na + S = Na2S | ||||
| Na0 - 1ē ⟶ Na+ | 1 | 2 | 2 | |
| S0 + 2ē ⟶ S-2 | 2 | 1 | ||
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2O + CO2↑
2H+ + CO32- = H2O + CO2↑
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
2Na+ + CO32- + 2H+ + 2NO3- = 2Na+ + 2NO3- + H2O + CO2↑
2H+ + CO32- = H2O + CO2↑
Na2S + PbI2 = 2NaI + PbS↓
2Na+ + S2- + Pb2+ + 2I- = 2Na+ + 2I- + PbS↓
Pb2+ + S2- = PbS↓
Na2S + H2SO4 = Na2SO4 + H2S↑
2Na+ + S2- + 2H+ + SO42- = 2Na+ + SO42- + H2S↑
2H+ + S2- = H2S↑
| 2NaI + 2H2O `overset("электролиз")(=)` 2NaOH + H2↑ + I2 | ||||
| 2I- - 2ē ⟶ I20 | 2 | 2 | 1 | |
| 2H2O + 2ē ⟶ H2 + 2OH- | 2 | 1 | ||
NaI + AgNO3 = NaNO3 + AgI↓
Na+ + I- + Ag+ + NO3- = Na+ + NO3- + AgI↓
Ag+ + I- = AgI↓
2NaNO3 + H2SO4(конц.) = Na2SO4 + 2HNO3↑
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- = BaSO4↓